Die zentrale Bedeutung des Nierenfunktionsverlusts gegenüber der Albuminurie
In westlichen Industrieländern wie den USA ist die Inzidenz der terminalen Niereninsuffizienz bei Typ-1-Diabetikern trotz Implementierung verschiedenster progressionsverzögernder Maßnahmen leider nicht im Sinken begriffen, für ältere Diabetiker ist die Tendenz sogar steigend.1 Das mag zum Einen daran liegen, dass eine Progressionsverzögerung, wie durch RAS-Blockade, die Dialysepflicht lediglich postponiert und/oder auch dass die zugrundeliegende Pathophysiologie sich nicht an das Lehrbuch hält.
Albuminurie als primärer Therapiefokus?
Tatsächlich war und ist ein „Albumin-zentrisches“ Bild bestimmend für die meisten Leitlinien, wonach die diabetische Nephropathie (DN) früh mit einer Albuminurie beginnt, welche progressiv zunimmt und letztlich über Abnahme der glomerulären Filtrationsrate (GFR) schließlich zum terminalen Nierenversagen führt. Das pathophysiologische Korrelat ist eine primär diabetisch bedingte glomeruläre Schädigung inklusive glomerulärer Hyperfiltration in den frühen DN-Stadien. Daraus folgt recht simpel gedacht eine Therapie der DN, welche primär das Ziel verfolgt, die Albuminurie zu reduzieren.2, 3 Eine Reihe von klinischen Beobachtungen widersprechen aber dieser vereinfachenden Sichtweise, mehr noch, diese Sicht könnte möglicherweise sogar falsch sein.4, 5, 6 So besitzt die Joslin Diabetes Clinic (Boston, MA) eine sorgsam beobachtete und analysierte Patientenkohorte mit über 4.000 Typ-1- und über 16.000 Typ-2-Diabetikern seit 1991, die zum größten Teil dem Zentrum treu bleiben, womit eine optimale Adhärenz gewährleistet ist. Rezent hat Andrzei Krolewski die beschriebene Hypothese anhand dieser Joslin-Studies noch einmal diskutiert und dabei eine neue Hypothese aufgestellt, wonach die Albuminurie nicht mehr im Zentrum der Pathogenese der DN steht, sondern die GFR.6
Ungereimtheiten zu GFR-Verlust und Albuminurie
In der sog. zweiten Joslin Kidney Study mit 595 normoalbuminurischen (NA) und 513 mikroalbuminurischen (MA) Patienten wurden die Patienten über ein Jahrzehnt beobachtet.7 Dabei wurde eine Progression eines GFR-Verlusts („decliners“) bei 10 % der NA- und 32 % der MA-Patienten beobachtet – so weit, so gut. Aber Achtung: hier könnte schon ein sog. Versicherungs-Bias („ascertainment bias“) existieren, da vor allem jene Patienten, deren Nierenfunktion schlechter wird, eine Albuminurie entwickelt haben könnten! Bei genauerer Betrachtung zeigt sich, dass jene Patienten, deren GFR bei Studienbeginn hoch, also über dem Median von 105 ml/min/1,73 m2 lag, über mehrere Jahre ein stabile Nierenfunktion hatten, ehe diese plötzlich deutlich abnahm, und etwa die Hälfte von diesen interessanterweise dann erst im Rahmen dieses Prozesses eine Albuminurie entwickelten. Die interindividuellen GFR-Verläufe unterschieden sich dabei enorm, von einem projektierten Erreichen der Dialysepflicht zwischen 5 bis hin zu 30 Jahren ab Beginn der ersten dokumentierten GFR-Abnahme. In über 70 % der MA-Patienten war während des gesamten Beobachtungszeitraums die GFR stabil, die restlichen Patienten wiesen entweder eine frühe oder abrupte und späte Abnahme ihrer GFR auf, wobei auch hier interessanterweise bevor die MA einsetzte, die Verteilung der Patienten hinsichtlich GFR-Schicksal überhaupt nicht prädiktiv war. Jahre nach Einsetzen des GFR-Verlusts waren immer noch über 50 % der Patienten nicht proteinurisch, während bei den GFR-stabilen Patienten die MA entweder makroalbuminurisch wurde oder sich sogar eine Regression der Albuminurie bei diesen Patienten zeigte.
Suche nach Prädiktoren des terminalen Nierenversagens
In der Joslin Proteinuria Cohort konnten Skupien und Mitarbeiter zeigen, dass bei über 240 Patienten, die eine GFR > 60 ml/min/1,73 m2 aufwiesen und über 7 bis 18 Jahre beobachtet wurden, hochdivergente GFR-Verläufe existieren.8, 9 Ähnliche Beobachtungen mit besseren statistischen Methoden sind in der jüngeren Vergangenheit über CKD-Patienten generell immer häufiger aufgetaucht und zeigen, dass der modellhafte GFR-Verlauf, wie in Lehrbüchern und nach Lehrmeinung für die DN dargestellt, mit der Realität selten übereinstimmt.
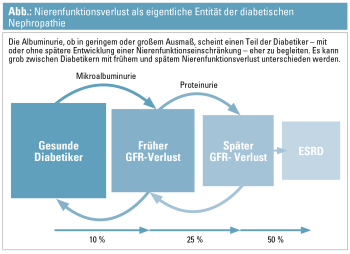
Faktoren, welche prädiktiv für ein später auftretendes Nierenversagen waren und die sowohl bei NA- als auch MA-Patienten vorkommen, waren vielfältig, darunter ein supranormal bis klar erhöhter Harnsäurespiegel. Dass Harnsäure möglicherweise ein kausaler renaler Risikofaktor sein könnte, ist mittlerweile bekannt, eine entsprechende sinnvolle Interventionsstudie bei Diabetes und Niereninsuffizienz wird derzeit gestartet (Preventing Early Renal Loss in Diabetes [PERL] Study). Ein weiterer assoziierter prädiktiver Faktor ist der Tumor-Nekrose-Faktor-Rezeptor 1 bzw. 2 (TNFR1/2), der negativ mit dem Harnsäurespiegel interagiert und mit diesem damit offenbar einen final common pathway hat.8 Insgesamt zeigt sich, dass die GFR-Verläufe bei Typ-1-Diabetikern in a) stabil, b) langsam, c) moderat und d) schnell hinsichtlich des GFR-Abfalls eingeteilt werden können. In allen Gruppen – d. h. NA-, MA- und overt proteinurischen Patienten – zeigt sich konsistent, dass dem Großteil der Patienten das terminale Nierenversagen erspart bleibt, mehr noch können angesichts dieser Daten weder Serum-Kreatinin noch die Albuminurie herangezogen werden, um das Ausmaß eines künftigen GFR-Verlaufs oder der Zeit bis zu einem terminalen Nierenversagen individuell zu berechnen oder zu prognostizieren (Abb.).
Gegenwärtig laufen Studien, um zu evaluieren, ob Cystatin C und TNFR1 oder 2 zusätzlich zu Albuminurie und Serum-Kreatinin eine bessere Stratifizierung der Patienten erlaubt.6 Wichtig sind diese Studien deshalb, da die Albuminurie – wie schon so oft geschehen – überhaupt keinen sinnvollen Parameter darstellt, um eine renoprotektive Therapie zu evaluieren, vielmehr muss die Nierenfunktion als solche über den Studienzeitraum berücksichtigt werden. Zudem wirkt eine Therapie wie etwa eine weitgehende Optimierung der Blutzuckereinstellung oft viel später mit einer „Lag“-Periode. Befinden sich in typischen DN-Interventionsstudien etwa Patienten, die auch ohne irgendeine Therapie keine Progression ihres Nierenfunktionsabfalls zeigen, so ist der Endpunkt der Studie natürlich zusätzlich negativ beeinflusst zu Ungunsten einer möglicherweise effektiven Therapie.
AUSBLICK: In anderen medizinischen Disziplinen, wie vor allem der Hämato-Onkologie, hat sich mittlerweile bereits eine effektive individualisierte Therapie entwickelt. Die Daten der Gruppe aus Boston deuten darauf hin, dass auch bei Patienten mit v. a. Typ-1-Diabetes eine individuelle Therapie möglich sein kann. Da bekanntermaßen die pathophysiologischen Grundlagen einer chronischen Nierenerkrankung bei Typ-2-Diabetes noch heterogener sind – diverse Querschnittstudien mit Nierenbiopsien bei Diabetikern zeigen bis zu 40 % gänzlich andere als typisch diabetische histologische Veränderungen –, sollte diesen Patienten erst recht eine Therapieindividualisierung angeboten werden können.
Evaluationen einer einzigen kurativen Therapie für alle DN-Patienten scheinen angesichts der vorliegenden Daten bei Diabetikern mit Nierenerkrankung nicht zielführend zu sein.
